Medizinforschungsgesetz
| Offizieller Titel: | Medizinforschungsgesetz |
| Initiator: | Bundesministerium für Gesundheit |
| Status: | Verabschiedet, noch nicht verkündet |
| Letzte Änderung: | 04.07.2024 |
| Drucksache: | 20/11561 (PDF-Download) |
| Beschlussempfehlung: | 20/12149 (PDF-Download) |
| Gesetztyp: | Einspruchsgesetz |
| Trojanercheck: |  |
| Hinweis: | In der Beschlussempfehlung wurden noch Änderungen von Kostenregelungen im Krankenhaus- Entgeltgesetz und im Implantate-Registergesetz ergänzt. In beiden werden Bußgeldvorschriften für unterlassene Datenmeldungen neu geregelt und an andere Gesetzesänderungen angepasst. |
Diese Zusammenfassung wurde mit GPT4 auf Basis des Gesetzentwurfs erstellt.
Basisinformationen
Das wesentliche Ziel des Gesetzentwurfs ist die Verbesserung der Rahmenbedingungen für die Entwicklung, Zulassung und Herstellung von Arzneimitteln und Medizinprodukten in Deutschland. Ein Kernstück des Gesetzes ist die Verzahnung verschiedener Verfahren im Bereich der Medizinforschung, um Prozesse insbesondere für forschende Pharmaunternehmen effizienter zu gestalten. Ebenso sollen Verfahren vereinfacht und beschleunigt werden, wobei hohe Sicherheitsstandards für Patientinnen und Patienten gewahrt bleiben sollen. Federführende Ministerien sind das Bundesministerium für Gesundheit und das Bundesministerium für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz.
Hintergrund
Als Hintergrundinformation kann aus dem Entwurfstext entnommen werden, dass Deutschland im internationalen Vergleich an Attraktivität verloren hat, was den Forschungs- und Produktionsstandort betrifft. Dies wurde von der Bundesregierung mit einem Strategiepapier "Verbesserung der Rahmenbedingungen für den Pharmabereich in Deutschland" am 13. Dezember 2023 aufgegriffen und soll nun mit diesem Gesetzentwurf angegangen werden.
Kosten
Für den Bundeshaushalt und die Länder entstehen folgende Kosten: Das BfArM sowie das PEI haben Mehrausgaben von etwa 68.000 Euro jährlich, während beim Bund zusätzliche Ausgaben in Höhe von circa 1.500.000 Euro pro Jahr anfallen. Die Länder werden um etwa 1.225.000 Euro jährlich entlastet. Das BfS hat eine jährliche Kostensenkung von 256.000 Euro, jedoch fallen hier auch Gebühreneinnahmen in gleicher Höhe weg. Die Einnahmen, die aus Gebühren und Kosten für die wissenschaftliche Beratung gemäß § 183 Absatz 1 Nummer 4a StrlSchG erwachsen, können noch nicht konkret beziffert werden. Der einmalige Erfüllungsaufwand beläuft sich auf etwa 67.000 Euro.
Inkrafttreten
Keine Angaben zum konkreten Inkrafttretensdatum des Gesetzes. Daher kann anhand der Standardvorgabe davon ausgegangen werden, dass das Gesetz am Tag nach der Verkündung in Kraft treten soll.
Sonstiges
Besonders erwähnenswert ist die Etablierung einer Spezialisierten Ethik-Kommission für besondere Verfahren sowie Änderungen in verschiedenen anderen Bereichen wie dem Strahlenschutzgesetz und der KPBV. Der Gesetzentwurf scheint nicht als besonders eilbedürftig dargestellt zu sein. Eine übergreifende Koordinierungsstelle soll beim BfArM eingerichtet werden. Des Weiteren gibt es die neue Option für pharmazeutische Unternehmen, vertrauliche Erstattungsbeträge bei Arzneimitteln mit neuen Wirkstoffen zu vereinbaren. Evaluierungen für bestimmte Teile des Gesetzes sind nach zwei, beziehungsweise fünf Jahren angedacht.
Maßnahmen:
- Vereinfachung der Kennzeichnung von Prüf- und Hilfspräparaten.
- Befreiungen von der Herstellungserlaubnispflicht für manche Zubereitungen von radioaktiven Arzneimitteln im Krankenhauskontext.
- Vereinfachung der Genehmigungsverfahren bei mononationalen klinischen Prüfungen.
- Animation von Sponsoren, eine bedarfsgerechte Lieferung von Prüf- und Hilfsarzneimitteln zu gewährleisten.
- Errichtung einer neuen Spezialisierten Ethik-Kommission für bestimmte Arzneimittelprüfungen.
- Einführung von Standardvertragsklauseln zur Vereinfachung von Verträgen zu klinischen Prüfungen.
- Anpassungen bei der direkten Arzneimittelabgabe im Rahmen von klinischen Prüfungen.
- Straffung der Verfahrensabläufe zwischen den Arzneimittelzulassungsbehörden.
- Optionale Geheimhaltung der Erstattungsbeträge bestimmter Arzneimittel gegenüber öffentlichen Verzeichnissen.
Stellungnahmen:
- Der Nationale Normenkontrollrat bewertet den Regelungsentwurf überwiegend positiv, wies jedoch auf die Komplexität in Bezug auf die neuen vertraulichen Erstattungsbeträge hin.
- Der Bundesrat hat in mehreren Punkten Änderungswünsche und Bitten zur Prüfung weiterer Maßnahmen vorgebracht, was vor allem die Ethik-Kommission, die Fristverkürzung bei mononationalen Studien und die transparente Definition von Sponsorschaft und Co-Sponsorschaft in Verträgen für klinische Prüfungen betrifft.
- Die Gegenäußerung der Bundesregierung zum Bundesrat lehnt einen Großteil der Änderungsanforderungen gerne ab, argumentiert jedoch gegen eine zu hohe Intervenierung privater Vertragsfreiheiten und die Notwendigkeit, eine neue Spezialisierte Ethik-Kommission einzurichten.
Zusammengefasst fokussiert die Bundesregierung auf die Vereinfachung und Effizienzsteigerung in der Arzneimittelforschung und deren Genehmigungsverfahren, während der Bundesrat Schutzaspekte, vor allem für minderjährige Probanden, sowie Transparenz und Unabhängigkeit der Forschung intensiver gewährleistet sehen möchte. Die Einführung vertraulicher Erstattungsbeträge wird kontrovers diskutiert, wobeidie Bundesregierung einen Anstieg der Forschungsfreundlichkeit, der Bundesrat hingegen Intransparenz fürchten.
| Datum erster Entwurf: | 17.01.2024 |
| Datum Kabinettsbeschluss: | 27.03.2024 |
| Weiterführende Informationen: | Vorhabenseite des Ministeriums |
„Mit dem Medizinforschungsgesetz sollen die Rahmenbedingungen für die Entwicklung, Zulassung und Herstellung von Arzneimitteln und Medizinprodukten verbessert werden. Es stärkt die Attraktivität des Standorts Deutschland im Bereich der medizinischen Forschung, beschleunigt den Zugang zu neuen Therapieoptionen für Patientinnen und Patienten und fördert Wachstum und Beschäftigung.
Ein Kernstück ist die Verzahnung des strahlenschutzrechtlichen Anzeige- und Genehmigungsverfahrens von Anwendungen radioaktiver Stoffe oder ionisierender Strahlung am Menschen zum Zweck der medizinischen Forschung mit den medizinprodukterechtlichen Genehmigungs- oder Anzeigeverfahren und den Verfahren zur Genehmigung einer klinischen Prüfung mit Arzneimitteln im Sinne des § 4 Absatz 23 AMG. Diese Verzahnung ist auch im Strategiepapier der Bundesregierung "Verbesserung der Rahmenbedingungen für den Pharmabereich in Deutschland" vorgesehen. Mit diesem Schritt wird einem wesentlichen Anliegen der forschenden Pharmaindustrie Rechnung getragen. Die Antragseinreichung bei verschiedenen Behörden und das zeitliche Auseinanderfallen der unterschiedlichen Verfahren wurden insbesondere von Unternehmen der Pharmaindustrie als zeitintensiv und kostenaufwändig kritisiert.“
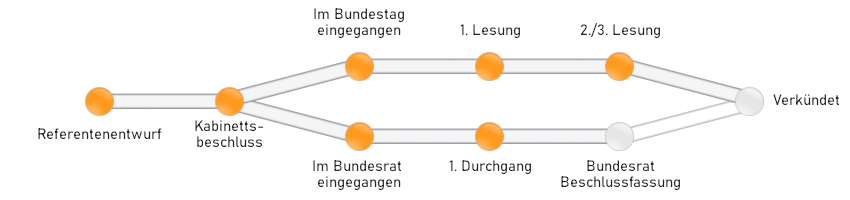
| Eingang im Bundestag: | 29.05.2024 |
| Erste Beratung: | 06.06.2024 |
| Abstimmung: | 04.07.2024 |
| Drucksache: | 20/11561 (PDF-Download) |
| Beschlussempfehlung: | 20/12149 (PDF-Download) |
| Plenarsitzungen: | Aufzeichnungen und Dokumente |
Ausschusssitzungen
Die Daten wurden mit GPT4 ermittelt und können Fehler enthalten. Im Zweifel bitte die verlinkten Dokumente prüfen.
| Ausschuss | Sitzungsdatum | Tagesordnung (PDF) |
|---|---|---|
| Ausschuss für Bildung, Forschung und Technikfolgenabschätzung | 03.07.2024 | Tagesordnung Tagesordnung |
| Ausschuss für Gesundheit | 12.06.2024 | Anhörung Tagesordnung Anhörung |
| Ausschuss für Gesundheit | 03.07.2024 | Tagesordnung Tagesordnung |
| Ausschuss für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz | 03.07.2024 | Tagesordnung |
| Wirtschaftsausschuss | 03.07.2024 | Ergänzung |
Diese Zusammenfassung wurde mit GPT4 auf Basis des Artikels auf bundestag.de erstellt.
Die Anhörung fand am 12.06.2024 im Ausschuss für Gesundheit statt.
Kritik an vertraulichen Erstattungsbeträgen
Bei der Anhörung im Bundestag zum Medizinforschungsgesetz wurden verschiedene Sachverständige gehört, welche unterschiedliche Aspekte des Gesetzentwurfs kritisch beleuchtet haben.
Eine Sprecherin des GKV-Spitzenverbandes äußerte starke Bedenken hinsichtlich der Einführung vertraulicher Erstattungsbeträge, die nach ihrer Meinung in der nächsten Dekade Zusatzkosten von bis zu 33 Milliarden Euro verursachen könnten. Sie hob hervor, dass Kosten in einer Höhe über 1,5 Milliarden Euro bereits konkrete Auswirkungen auf den Beitragssatz hätten.
Vertreter des AOK-Bundesverbands begrüßten den Abbau bürokratischer Hürden und die Beschleunigung von Prüfverfahren, waren jedoch der Ansicht, dass der vertrauliche Erstattungsbetrag nicht mit der Zielsetzung korrespondiere, den Forschungs- und Produktionsstandort zu fördern, und den europaweiten Bestrebungen nach Transparenz und angemessenen Arzneimittelpreisen zuwiderlaufe.
Vom Bundesverband des pharmazeutischen Großhandels (Phagro) wurde die Sorge vor höheren Einkaufspreisen und in der Folge steigenden Fremdkapitalkosten artikuliert, was die Pharmaunternehmen direkt treffen würde.
Ein Vertreter des Verbands der forschenden Pharmaunternehmen (vfu) argumentierte, dass Verbesserungen für den Studienstandort Deutschland nur in Kombination mit innovationsfreundlichen Erstattungsbedingungen Erfolg versprechen würden und kritisierte die derzeitigen starren Restriktionen des Arzneimittelmarktneuordnungsgesetzes (AMNOG), die die Einführung innovativer Medikamente behinderten.
Vertreter der Bundesärztekammer (BÄK) zeigten sich besorgt über die Einrichtung einer neuen, spezialisierten Ethik-Kommission auf Bundesebene, die ihrer Meinung nach aufgrund ihrer strukturellen Anbindung an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) nicht den Anforderungen der Deklaration von Helsinki entspreche und somit die Unabhängigkeit ethischer Bewertungen gefährde.
Der Arbeitskreis Medizinischer Ethik-Kommissionen (AKEK) sprach sich gegen die Gründung einer spezialisierten Ethik-Kommission aus und betonte, dass die vorhandenen Kommissionen die nötige Expertise bereits besäßen. Die Einrichtung führe zu mehr Bürokratie, ohne die Verfahren tatsächlich zu beschleunigen.
Die in der Anhörung geäußerten Standpunkte und Argumentationen spiegeln eine breite Palette an Sorgen und Kritikpunkten bezüglich verschiedener Aspekte des Gesetzentwurfs wider.
Zusammenfassung der Beschlussempfehlung
Diese Zusammenfassung wurde mit GPT4 auf Basis des Textes des Beschlussempfehlung erstellt.
Zusammenfassung wird nachgereicht
| Gesetztyp: | Einspruchsgesetz |
| Drucksache: | 155/24 |
| Eingang im Bundesrat: | 05.04.2024 |
| Erster Durchgang: | 17.05.2024 |